IBS 연구단 성과 세계 최고 권위 학술지 ‘사이언스’ 게재
메신저 리보핵산의 중요성 비해 체내 작동 원리 규명은 ‘난제’
mRNA의 체내 유입 촉진하는 단백질, 분해효소 최초 발견
감염병, 암, 면역, 유전자 등 질병 치료의 새 단초 마련
[충청투데이 김중곤 기자] 국내 연구진이 코로나19 백신의 핵심이었던 메신저 리보핵산(mRNA)이 구체적으로 어떻게 작동한 것인지 그 원리를 세계 최초로 밝혀냈다.
mRNA는 감염병뿐만 아니라 암, 면역 및 유전자 치료 등 활용도가 높은 만큼 이번 연구 성과가 인류의 각종 질병 치료에 획기적인 전환점을 이끌지 주목된다.
4일 과학기술정보통신부에 따르면 mRNA 백신의 세포 내 전달·분해를 제어하는 단백질 군을 찾고 그 작동 원리를 규명한 김빛내리 기초과학연구원(IBS) 연구단장 연구진의 연구 결과가 세계 최고 권위 학술지 사이언스(Science, IF 44.7)에 이날 온라인 게재됐다.
mRNA는 단백질을 합성할 수 있는 DNA 유전정보를 세포질 안의 리보솜에 전달하는 역할을 한다.
mRNA 합성 기법과 이를 보호하며 세포에 효율적으로 전달하는 지질나노입자가 개발되며 mRNA 기술은 혁신적인 치료 플랫폼으로 성장하고 있다.
하지만 그동안 치료용 RNA가 체내에서 어떻게 작동, 조절되는지 구체적인 원리가 알려지지 않았다.
단적으로 코로나 백신의 주역인 N1-메틸도유리딘 변형 염기는 mRNA 백신의 효능 혁신과 상용화를 이끌었지만, 정확히 무엇이 효능을 높였고 원리가 무엇인지는 분명치 않았다.
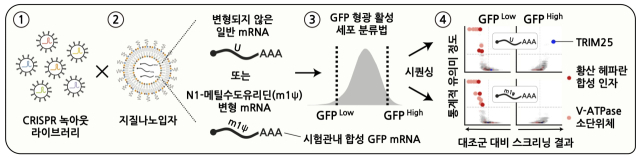
IBS 연구진은 세계적 난제를 풀고자 유전자가위(크리스퍼)를 이용해 약 2만개의 유전자를 대상으로 녹아웃 스크리닝(선별 제거)을 진행했다.
그 결과 연구진은 mRNA의 세포 내 전달·유입에 있어 ‘황산 헤파란’이란 당단백질과 ‘V-ATPase’이란 분해효소가 필요하다는 사실을 세계 최초로 알아냈다.
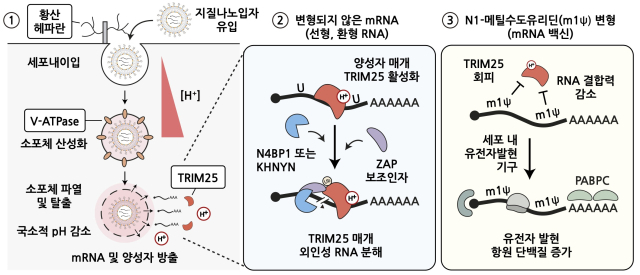
규명한 원리를 구체적으로 살피면 먼저 세포막 표면에 있는 황산 헤파란이 mRNA를 감싼 지질나노입자와 결합하며 세포 내 유입을 촉진하고, 지질나노입자는 세포 내 소포체로 들어간다.
이후 지질나노입자는 소포체 안을 산성화시킨 V-ATPase에 의해 양전화를 띄게 되며 소포체 막을 일시적으로 파열시키고, 이로 인해 mRNA가 세포질로 방출돼 단백질로 발현된다는 것이 연구진의 설명이다.
나아가 IBS 연구진은 외부에서 침입한 RNA를 제거하는 체내 'TRIM25' 단백질의 존재로 파악하는 한편, 왜 해당 단백질이 코로나 치료의 핵심이었던 N1-메틸수도유리딘 변형 염기에는 덜 민감하게 반응했는지도 밝혀냈다.
세포질 내 TRIM25는 mRNA를 침입자로 인식해 이와 특이적으로 표적·결합하는 방식으로 제거하는데, N-1메틸수도유리딘 변형 염기에선 그 결합력이 현저히 감소했다는 분석이다.
코로나 mRNA 백신의 효능과 안정성을 향상할 수 있었던 배경에 TRIM25의 결합력이 숨어 있었다는 점을 찾아낸 것이다.
과기부 관계자는 “mRNA 백신의 세포 내 작동 원리를 최초로 밝혀냄으로써 mRNA 치료제의 효능과 안정성을 한 단계 높여갈 이론적 토대가 마련됐다는 데 큰 의미가 있다”고 말했다.
김 단장은 “양성자 이온이 면역 신호 전달 물질로 작용한다는 사실을 최초로 발견하고 외부 침입자에 대항하는 세포의 방어 기전에 대한 이해를 한층 넓혀 RNA뿐 아니라 면역, 세포신호 분야에도 새로운 연구 방향을 제시할 것으로 보인다”고 강조했다.
김중곤 기자 kgony@cctoday.co.kr
